ベバシズマブBS「アムジェン」の結腸・直腸癌における効能又は効果、用法及び用量は次のとおりです。
●効能又は効果[1]
治癒切除不能な進行・再発の結腸・直腸癌
○治癒切除不能な進行・再発の結腸・直腸癌
4. ベバシズマブBS「アムジェン」は、フッ化ピリミジン系薬剤を含む他の抗悪性腫瘍剤との併用により投与してください。
5. ベバシズマブBS「アムジェン」の用法・用量は、「17.臨床成績」の項の内容を熟知した上で、ベバシズマブBS「アムジェン」と併用する他の抗悪性腫瘍剤及び患者のがん化学療法歴に応じて選択してください。
※最新の情報は電子添文をご確認ください。電子添文のリンクはこちら
ヒト血管内皮細胞増殖因子(vascular endothelial growth factor:VEGF)は、血管内皮細胞の細胞分裂促進・生存の制御、血管透過性の亢進に関与するサイトカインであり、種々の癌細胞で発現が亢進しています[1]。
ヒトVEGFと特異的に結合するヒト化モノクローナル抗体ベバシズマブは、VEGFを介したシグナル伝達経路を阻害することで、腫瘍組織の血管新生を抑制し、腫瘍増殖を阻害します[1]。また、VEGFにより亢進した血管透過性を低下させ、腫瘍組織で亢進した間質圧を低減します。
※最新の情報は電子添文をご確認ください。電子添文のリンクはこちら
ベバシズマブBS「アムジェン」の禁忌は次のとおりです。
1. 本剤の成分に対し過敏症の既往歴のある患者さん[1]
[解説]
本剤はヒト化マウスモノクローナル抗体であり、製造時にCHO(チャイニーズハムスター卵巣)細胞を用いていること、及びポリソルベート等の添加剤を含んでいることから、これらの成分による過敏症の既往のある患者さんではその成分に対する抗体が存在する可能性があります。投与前に十分な問診を行い、過去に本剤の成分を含む製剤における過敏症の既往歴がないかを確認する必要があります。
2. 喀血(2.5mL以上の鮮血の喀出)の既往のある患者さん[1]
[解説]
先行バイオ医薬品(アバスチン)の海外臨床試験において喀血の死亡例が認められ、既往歴として喀血が報告されていたことから喀血の既往歴が重篤な喀血発現のリスク因子として示唆されました。
※最新の情報は電子添文をご確認ください。電子添文のリンクはこちら
※最新の情報は電子添文をご確認ください。電子添文のリンクはこちら
ベバシズマブBS「アムジェン」の血管外漏出について、特異的な対処法はありません。
参考ですが、先行バイオ医薬品(アバスチン)は、血管外漏出の組織障害性に基づく分類において非壊死性薬剤※に該当します[1]。
※非壊死性薬剤(ノンビシカント薬剤):薬剤が漏れ出たときに、組織が障害を受けたり破壊されたりすることはない(可能性は非常に低い)といわれている薬剤です[2]。
<引用>
1. Boulanger Jほか:Support Care Cancer 23(5) Page:1459-1471 (2015.5)(BEV00245)
2. 外来がん化学療法看護ガイドライン 2014年版 Page:27(BEV00248)
※最新の情報は電子添文をご確認ください。電子添文のリンクはこちら
〈解説〉
胎児の発育において血管新生は極めて重要であると認められており、母体のIgGは胎盤関門を通過することが知られています。したがって、本剤により胎児の血管新生が阻害される可能性があります。妊娠している患者さんにおいては、本剤の投与により重大な妊娠転帰に至ることが考えられるため、妊婦または妊娠している可能性のある患者さんにおいては本剤を用いるべきではなく、治療上の有益性が危険性を上回ると判断される場合にのみ投与してください[2]。
なお、本剤では妊婦及び授乳時の使用を検討するための臨床試験を実施していないため、安全性についても確立していません[2]。
<引用>
1. ベバシズマブBS「アムジェン」 電子添文
2. ベバシズマブBS「アムジェン」 インタビューフォーム
※最新の情報は電子添文をご確認ください。電子添文のリンクはこちら
本剤投与終了後、最低6ヵ月間は避妊法を用いるよう説明してください。
妊娠する可能性がある女性には、本剤投与中及び最終投与後6カ月間において避妊する必要性及び適切な避妊法について説明してください[1]。
なお、本剤では妊婦および授乳時の使用を検討するための臨床試験を実施していないため、安全性については確立していません[2]。
<引用>
1. ベバシズマブBS「アムジェン」 電子添文
2. ベバシズマブBS「アムジェン」 インタビューフォーム
※最新の情報は電子添文をご確認ください。電子添文のリンクはこちら
●授乳婦に投与する場合の注意[1]
本剤を授乳婦に投与する場合には、治療上の有益性および母乳栄養の有益性を考慮し、授乳の継続または中止を検討してください。
本剤のヒト乳汁中への移行性については不明ですが、ヒトIgGは乳汁中に移行することが知られています。
〈解説〉
授乳中の患者さんは、臨床試験の対象から除外されていたため、そのような患者さんにおける安全性情報は確認していません[2]。
<引用>
1. ベバシズマブBS「アムジェン」 電子添文
2. ベバシズマブBS「アムジェン」 インタビューフォーム
※最新の情報は電子添文をご確認ください。電子添文のリンクはこちら
●高齢の患者さんに投与する場合の注意[1]
患者さんの状態を十分に観察しながら慎重に投与してください。海外臨床試験において、65歳未満の患者さんと比較し、65歳以上の患者さんで本剤投与による脳卒中、一過性脳虚血発作、心筋梗塞等の動脈血栓塞栓症の発現率の上昇が認められました。
〈解説〉
先行バイオ医薬品(アバスチン)の海外臨床試験において、65歳未満の患者さんと比較し、65歳以上の患者さんで本剤(アバスチン)投与による脳卒中、一過性脳虚血発作、心筋梗塞等の動脈血栓塞栓症の発現率の上昇が認められました[2]。
<引用>
1. ベバシズマブBS「アムジェン」 電子添文
2. ベバシズマブBS「アムジェン」 インタビューフォーム
※最新の情報は電子添文をご確認ください。電子添文のリンクはこちら
●肝機能障害患者さんに投与する場合の注意[1]
肝機能障害患者さんに対する注意喚起は行っておりません。
●用法及び用量
肝機能を指標とした用法及び用量は設定しておりません。
<引用>
1. ベバシズマブBS「アムジェン」 インタビューフォーム
※最新の情報は電子添文をご確認ください。電子添文のリンクはこちら
●腎機能障害患者さんに投与する場合の注意[1]
腎機能障害患者さんに対する注意喚起は行っておりません。
●用法及び用量
腎機能を指標とした用法及び用量は設定しておりません。
<引用>
1. ベバシズマブBS「アムジェン」 インタビューフォーム
※最新の情報は電子添文をご確認ください。電子添文のリンクはこちら
●透析患者さんに投与する場合の注意[1]
腎機能障害患者さんに対する注意喚起は行っておりません。
●用法及び用量[1]
腎機能を指標とした用法及び用量は設定しておりません。
〈参考〉
●透析除去率[1]
透析等による除去率について該当資料はありません。
●血漿蛋白結合率[1]
該当資料はありません。
●その他(重要な基本的注意における記載)[1]
重要な基本的注意:蛋白尿があらわれることがあるので、投与期間中は尿蛋白を定期的に検査することが望ましい。
解説:先行バイオ医薬品において国内外での使用経験から重度の蛋白尿(ネフローゼ症候群)が認められており、本剤投与により高血圧が発現、また一般的に腎機能の変化は高血圧発現のリスク因子になることも考慮すると蛋白尿の発現についても高血圧と同様に注意喚起が必要と考えられる。本剤の投与中は尿蛋白の定期的な検査を行うことが望ましい。
<引用>
1. ベバシズマブBS「アムジェン」 インタビューフォーム
※最新の情報は電子添文をご確認ください。電子添文のリンクはこちら
ベバシズマブBS[一般名 ベバシズマブ(遺伝子組換え)]は、ヒト血管内皮細胞増殖因子(vascular endothelial growth factor:VEGF)と特異的に結合するヒト化モノクローナル抗体であり、VEGFと血管内皮細胞上に発現する血管内皮細胞増殖因子受容体(vascular endothelial growth factor receptor:VEGFR)との結合を阻害することで、腫瘍組織での血管新生を抑制し、腫瘍増殖を阻害します[1]。また、VEGFにより亢進した血管透過性を低下させます。
ベバシズマブ(アバスチン)は、2004年に米国で初めて承認されました[1]。日本では、2007年に治癒切除不能な進行・再発の結腸・直腸癌に対する治療薬として承認され、現在では、扁平上皮癌を除く切除不能な進行・再発の非小細胞肺癌、卵巣癌、進行又は再発の子宮頸癌、手術不能又は再発乳癌、悪性神経膠腫、切除不能な肝細胞癌に対する治療薬としての承認も取得しています。
ベバシズマブBS「アムジェン」(以下、「本剤」)は、ベバシズマブ(アバスチン)(以下、「先行バイオ医薬品」)のバイオ後続品として、米国アムジェン社により開発されました[1]。本剤は、品質試験、非臨床試験において、先行バイオ医薬品と同等/同質の品質特性、生物活性を示しました。また、海外で実施された2つの第Ⅰ相単盲検試験(日本人集団を含む)に加えて、海外で実施された第Ⅲ相二重盲検試験の計3試験の結果から、本剤の薬物動態プロファイルに関して先行バイオ医薬品との同等性/同質性が確認されました。さらに、この第Ⅲ相二重盲検試験の結果から、本剤の臨床的有効性に関して先行バイオ医薬品との同等性/同質性が確認されました。以上の結果を受け、第一三共株式会社は製造販売承認申請を行い、2019年9月に承認を取得しました。
その後、2020年8月に「治癒切除不能な進行・再発の結腸・直腸癌」について1回7.5mg/kg(体重)、投与間隔3週間以上の用法及び用量追加、2020年9月に「扁平上皮癌を除く切除不能な進行・再発の非小細胞肺癌」、2022年8月に「手術不能又は再発乳癌」、2023年4月に「卵巣癌」、2023年12月に「悪性神経膠腫」の効能又は効果、用法及び用量追加の承認事項一部変更承認を取得しました[1]。
2025年7月に第一三共株式会社からアムジェン株式会社へ製造販売承認を承継し、販売名をベバシズマブBS点滴静注100mg「アムジェン」及び同点滴静注400mg「アムジェン」に変更しました。
<引用>
1. ベバシズマブBS「アムジェン」 インタビューフォーム
※最新の情報は電子添文をご確認ください。電子添文のリンクはこちら
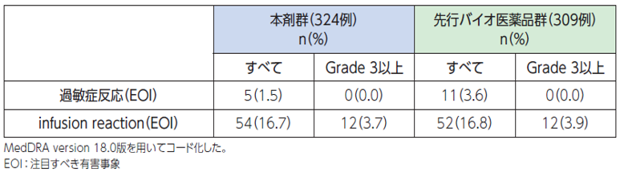
●具体的な事象名[1]
ショック、アナフィラキシー、infusion reaction(蕁麻疹、呼吸困難、口唇浮腫、咽頭浮腫 等)、過敏症反応
●副作用発現率[1]
非小細胞肺癌患者さんを対象とした本剤の海外第Ⅲ相臨床試験における過敏症反応関連事象、infusion reaction関連事象の副作用発現率は次のとおりでした。
●過敏症反応関連事象、infusion reaction関連事象の副作用発現率(海外データ)【図表】[1]
※最新の情報は電子添文をご確認ください。電子添文のリンクはこちら
●副作用が発現した場合の対処法[1]
ショック、アナフィラキシー、infusion reaction(蕁麻疹、呼吸困難、口唇浮腫、咽頭浮腫 等)があらわれることがあります。過敏症状が認められた場合は、本剤の投与を中止し、薬物治療(アドレナリン、副腎皮質ステロイド剤、抗ヒスタミン剤等)などの適切な処置を行ってください。
<引用>
1. ベバシズマブBS「アムジェン」 適正にご使用いただくために
消化管穿孔は、血管強度を維持する内皮細胞と血小板の相互作用が阻害されることにより起こる可能性があります。複数の機序が考えられますが、血管新生阻害(ベバシズマブBS等)、腸の虚血、化学療法剤が腫瘍に到達した結果、壊死や創傷治癒遅延に至り、消化管穿孔が起きると考えられます[1]。
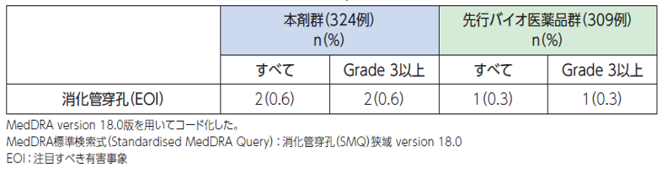
●具体的な事象名:消化管穿孔[1]
●副作用発現率[1]
非小細胞肺癌患者さんを対象とした本剤の海外第Ⅲ相臨床試験における消化管穿孔に関連する副作用発現率は次のとおりでした。
●消化管穿孔に関連する副作用発現率(海外データ)【図表】[1]
※最新の情報は電子添文をご確認ください。電子添文のリンクはこちら
●副作用が発現した場合の対処法[1]
死亡に至る例が報告されています。消化管穿孔と診断された場合は、重篤な消化管穿孔が再発するおそれがあるので、本剤を再投与しないでください。
<引用>
1. ベバシズマブBS「アムジェン」 適正にご使用いただくために
VEGF(血管内皮増殖因子)の阻害が、血管強度を維持する内皮細胞と血小板の相互作用にを妨げることによって、出血合併症、消化管穿孔ならびに創傷および潰瘍治癒阻害が生じ、瘻孔が起きると考えられます[1]。
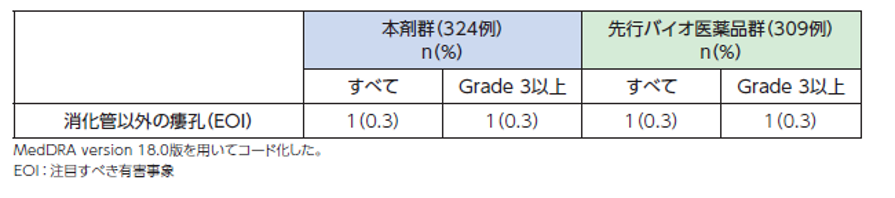
●具体的な事象名[1]
消化管瘻(腸管皮膚瘻、腸管瘻、気管食道瘻 等)、消化管以外の瘻孔(気管支胸膜瘻、泌尿生殖器瘻、胆管瘻 等)
●副作用発現率[1]
非小細胞肺癌*患者さんを対象とした本剤の海外第Ⅲ相臨床試験における瘻孔に関連する副作用発現率は次のとおりでした。
○消化管以外の瘻孔(Grade3以上:0.3%、すべて:0.3%)
●瘻孔に関連する副作用発現率(海外データ)【図表】[1]
●副作用が発現した場合の対処法[1]
消化管瘻(腸管皮膚瘻、腸管瘻、気管食道瘻 等)または消化管以外の瘻孔(気管支胸膜瘻、泌尿生殖器瘻、胆管瘻 等)があらわれることがあり、死亡に至る例が報告されています。また、気管食道瘻または重度の瘻孔があらわれた患者さんには、本剤を再投与しないでください。先行バイオ医薬品の子宮頸癌*患者さんを対象とした海外臨床試験では、消化管膣瘻(直腸膣瘻等)(8.3%)、消化管瘻(直腸瘻)(0.5%)、消化管以外の瘻(膀胱膣瘻等)(1.8%)が認められており、また発現例の多くは、骨盤部への放射線治療歴のある患者さんであったことが報告されています。
*本剤の効能又は効果は「治癒切除不能な進行・再発の結腸・直腸癌」「扁平上皮癌を除く切除不能な進行・再発の非小細胞肺癌」「悪性神経膠腫」「卵巣癌」です。
<引用>
1. ベバシズマブBS「アムジェン」 適正にご使用いただくために
※最新の情報は電子添文をご確認ください。電子添文のリンクはこちら
創傷治癒遅延は、VEGF(血管内皮増殖因子)阻害が血管強度を維持する内皮細胞と血小板の相互作用を妨げることよって起こる可能性があります。そのため、本剤により創傷治癒遅延が起きる可能性が考えられます[1]。
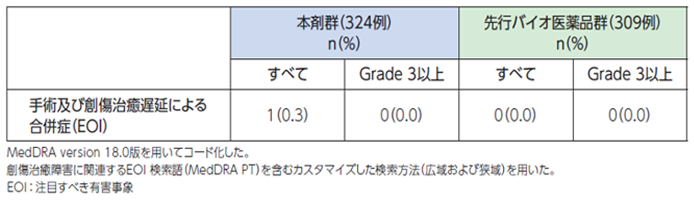
●具体的な事象名:創し開、術後出血などの合併症[1]
●副作用発現率[1]
非小細胞肺癌患者さんを対象とした本剤の海外第Ⅲ相臨床試験における創傷治癒遅延に関連する副作用発現率は次のとおりでした。
●創傷治癒遅延に関連する副作用発現率(海外データ)【図表】[1]
●副作用が発現した場合の対処法[1]
手術後の患者さんに本剤を投与する場合は、創傷の状態を確認し、投与の可否を検討してください。大きな手術の術創が治癒していない場合は、治療上の有益性が危険性を上回ると判断される場合を除き、本剤を投与しないでください。本剤の投与中に創傷治癒遅延による合併症があらわれた場合は、創傷が治癒するまで本剤の投与を中止し、適切な処置を行ってください。
●副作用の予防法[1]
創傷治癒遅延による合併症(創し開、術後出血等)があらわれることがあるので、本剤の投与終了後に手術を行う場合は、本剤の半減期を考慮し、本剤の投与終了からその後の手術まで十分な期間をおいてください。
<引用>
1. ベバシズマブBS「アムジェン」 適正にご使用いただくために
※最新の情報は電子添文をご確認ください。電子添文のリンクはこちら
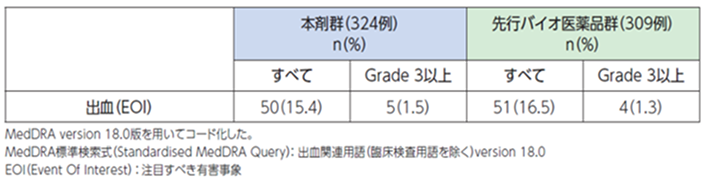
VEGF(血管内皮増殖因子)は、内皮細胞生存および血管内皮細胞間接着を制御します[1]。本剤のVEGF阻害作用により、細胞膜やマトリクス上の内皮細胞再生や凝固促進が阻害され、出血に至ることがあります[1]。
●具体的な事象名:消化管出血(吐血、下血)、肺出血(血痰、喀血)、脳出血、鼻出血、歯肉出血、膣出血 等[1]
●副作用発現率[1]
非小細胞肺癌患者さんを対象とした本剤の海外第Ⅲ相臨床試験における出血に関連する副作用発現率は次のとおりでした。
●出血に関連する副作用発現率(海外データ)【図表】[1]
●副作用が発現した場合の対処法[1]
肺出血(喀血)または重度の出血があらわれ、死亡に至る例が報告されているため、本剤の投与を中止し、適切な処置を行ってください。このような出血があらわれた患者さんでは、重度の出血が再発するおそれがあるので、本剤を再投与しないでください。
<引用>
1. ベバシズマブBS「アムジェン」 適正にご使用いただくために
※最新の情報は電子添文をご確認ください。電子添文のリンクはこちら
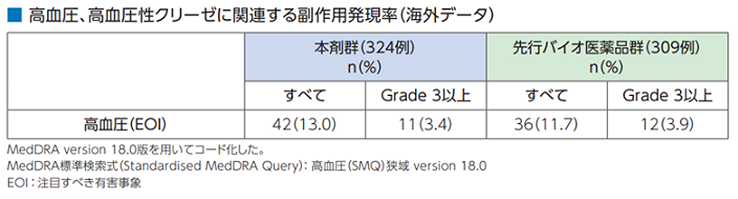
血管形成阻害剤による高血圧は、血管拡張作用の欠如だけでなく、新しい血管形成阻害による小動脈および細動脈の欠損により起こると考えられています[1]。また、VEGF(血管内皮増殖因子)阻害作用による腎臓の血圧コントロールも関与すると考えられています。
●具体的な事象名:高血圧、高血圧脳症、高血圧性クリーゼ[1]
●副作用発現率[1]
非小細胞肺癌患者さんを対象とした本剤の海外第Ⅲ相臨床試験における高血圧、高血圧性クリーゼに関連する副作用発現率は次のとおりでした。
●高血圧、高血圧性クリーゼに関連する副作用発現率(海外データ)【図表】[1]
●副作用が発現した場合の対処法[1]
コントロール不能の高血圧、高血圧脳症、高血圧性クリーゼがあらわれた場合には、本剤の投与を中止し、適切な処置を行ってください。また、高血圧脳症、高血圧性クリーゼが再発するおそれがあるので、このような患者さんには本剤を再投与しないでください。高血圧の発現率は、本剤の用量に相関して上昇する傾向が示唆されています。
●副作用の予防法[1]
高血圧があらわれることがあるので、投与期間中は血圧を定期的に測定し、適切な処置を行ってください。
<引用>
1. ベバシズマブBS「アムジェン」 適正にご使用いただくために
※最新の情報は電子添文をご確認ください。電子添文のリンクはこちら
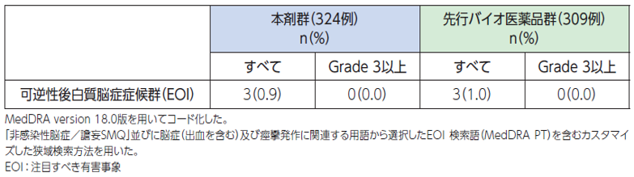
脳血流の調節不全による血管原性脳浮腫に続発する可逆性後白質脳症症候群(PRES)を引き起こすことがあり、高血圧を伴う例と伴わない例が報告されています[1]。
●具体的な事象名:PRES(症状:痙攣発作、頭痛、精神状態変化、視覚障害、皮質盲 等)[1]
●副作用発現率[1]
非小細胞肺癌患者さんを対象とした本剤の海外第Ⅲ相臨床試験におけるPRESに関連する副作用発現率は次のとおりでした。
●可逆性後白質脳症症候群(PRES)に関連する副作用発現率(海外データ)【図表】[1]
●副作用が発現した場合の対処法[1]
PRES(症状:痙攣発作、頭痛、精神状態変化、視覚障害、皮質盲等)があらわれることがあり、高血圧を伴う例と伴わない例が報告されています。PRESが疑われた場合には、MRIなどの画像診断を実施してください。また、本剤の投与を中止し、血圧のコントロール、抗痙攣薬の投与などの適切な処置を行ってください。
<引用>
1. ベバシズマブBS「アムジェン」 適正にご使用いただくために
※最新の情報は電子添文をご確認ください。電子添文のリンクはこちら
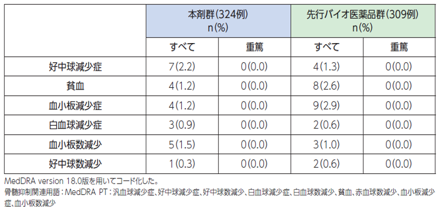
VEGF(血管内皮増殖因子)受容体は、ほとんどすべての造血細胞および内皮細胞に発現しており、骨髄抑制後の血球回復に関与していることから、本剤のVEGF阻害作用により骨髄抑制が起こると考えられます[1]。
●具体的な事象名:汎血球減少症、好中球減少、白血球減少、貧血、血小板減少[1]
●副作用発現率[1]
非小細胞肺癌患者さんを対象とした本剤の海外第Ⅲ相臨床試験における骨髄抑制に関連する副作用発現率は次のとおりでした。
●骨髄抑制に関連する副作用発現率(海外データ)【図表】[1]
●副作用が発現した場合の対処法[1]
他の抗悪性腫瘍剤との併用において汎血球減少症、好中球減少、白血球減少、貧血、血小板減少があらわれることがあります。なお、臨床試験で他の抗悪性腫瘍剤に本剤を併用した群において、併用していない群と比較して、高度の好中球減少症、発熱性好中球減少症の発現頻度が高まることが報告されています。
●副作用の予防法[1]
骨髄抑制があらわれることがあるので、定期的に血液検査を行うなど観察を十分に行ってください。
<引用>
1. ベバシズマブBS「アムジェン」 適正にご使用いただくために
※最新の情報は電子添文をご確認ください。電子添文のリンクはこちら
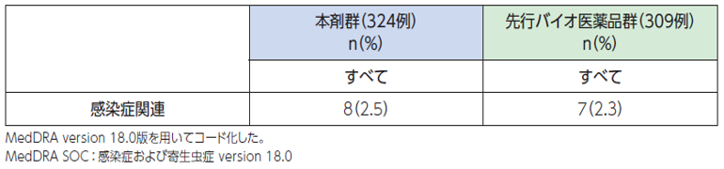
電子添文には、重大な副作用として感染症が報告されています。
●具体的な事象名:肺炎、敗血症、壊死性筋膜炎 等[1]
●副作用発現率[1]
非小細胞肺癌患者さんを対象とした本剤の海外第Ⅲ相臨床試験における感染症に関連する副作用発現率は次のとおりでした。
●感染症に関連する副作用発現率(海外データ)【図表】[1]
●副作用が発現した場合の対処法[1]
好中球減少の有無にかかわらず、肺炎(0.6%)、敗血症(0.2%)、壊死性筋膜炎(頻度不明)などの感染症があらわれ、死亡に至る例が報告されています。異常が認められた場合には、適切な処置を行ってください。
<引用>
1. ベバシズマブBS「アムジェン」 適正にご使用いただくために
※最新の情報は電子添文をご確認ください。電子添文のリンクはこちら
本剤をうっ血性心不全または冠動脈疾患などの重篤な心疾患のある患者さんに投与すると、うっ血性心不全が悪化またはあらわれるおそれがあります。
●具体的な事象名:うっ血性心不全、左室機能不全 等[1]
●副作用発現率[1]
非小細胞肺癌患者さんを対象とした本剤の海外第Ⅲ相臨床試験におけるうっ血性心不全に関連する副作用は認められませんでした。
●副作用が発現した場合の対処法[1]
うっ血性心不全が発現した症例の多くは、アントラサイクリン系薬剤の投与歴、左胸壁への放射線治療歴などのある患者さんでした。異常が認められた場合には適切な処置を行ってください。
<引用>
1. ベバシズマブBS「アムジェン」 適正にご使用いただくために
※最新の情報は電子添文をご確認ください。電子添文のリンクはこちら
電子添文には、重大な副作用として間質性肺炎が報告されています。
●副作用発現率[1]
非小細胞肺癌患者さんを対象とした本剤の海外第Ⅲ相臨床試験における間質性肺炎に関する副作用は認められませんでした。
●副作用が発現した場合の対処法[1]
間質性肺炎があらわれた場合、観察を十分に行い、異常が認められた場合には、本剤の投与を中止し、適切な処置を行ってください。
<引用>
1. ベバシズマブBS「アムジェン」 適正にご使用いただくために
※最新の情報は電子添文をご確認ください。電子添文のリンクはこちら
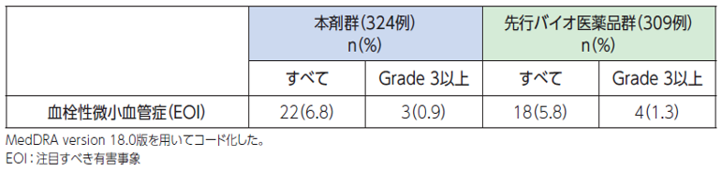
血管損傷や血栓形成により、血栓性微小血管症(TMA)を引き起こすことがあります[1]。
●具体的な事象名:血栓性血小板減少性紫斑病、溶血性尿毒症症候群 等[1]
●副作用発現率[1]
非小細胞肺癌患者さんを対象とした本剤の海外第Ⅲ相臨床試験におけるTMAに関連する副作用発現率は次のとおりでした。
●血栓性微小血管症(TMA)に関連する副作用発現率(海外データ)【図表】[1]
●副作用が発現した場合の対処法[1]
破砕赤血球を伴う貧血、血小板減少、腎機能障害などが認められた場合には、投与を中止し、適切な処置を行ってください。
●副作用の予防法[1]
血栓性微小血管症(TMA)があらわれることがあるので、定期的に検査を行うなど観察を十分に行ってください。
<引用>
1. ベバシズマブBS「アムジェン」 適正にご使用いただくために
※最新の情報は電子添文をご確認ください。電子添文のリンクはこちら
●脳転移を有する患者さんに投与する場合の注意[1]
脳腫瘍(脳転移を含む)を有する患者さんに本剤を投与する場合は、観察を十分に行い、脳出血が疑われるような症状が認められた場合は、本剤の投与中止を含めて適切な対応を行ってください。脳転移を有する患者さんで脳出血を認めた例が報告され、また、初発膠芽腫患者さんを対象とした国際共同臨床試験において、本剤の投与により脳出血の発現率が高くなる傾向が認められています。
〈解説〉[1]
脳転移を含む脳腫瘍を有する患者さんに対する本剤投与の要否は、個別の患者さんの状態等に応じて、リスク・ベネフィットを十分に考慮した上で、専門医が慎重に判断する必要があります。また、脳腫瘍を有する患者さんに投与する場合、本剤投与中及び投与後においては患者さんの状態を十分に観察し、神経学的異常が認められた場合には腫瘍の増大、新たな転移巣の出現及び脳出血の可能性を考慮して、本剤の投与中止を含めて適切な対応を行うことが必要です。
<引用>
1. ベバシズマブBS「アムジェン」 インタビューフォーム
※最新の情報は電子添文をご確認ください。電子添文のリンクはこちら
●先天性出血素因、凝固系異常のある患者さんに投与する場合の注意[1]
出血があらわれるおそれがあります。
〈解説〉[1]
先天性出血素因、後天性凝血異常を有する患者さんは、先行バイオ医薬品の臨床試験の対象から除外されたため、これらの患者さんに対する本剤の安全性情報は十分に確認されていません。
<引用>
1. ベバシズマブBS「アムジェン」 インタビューフォーム
※最新の情報は電子添文をご確認ください。電子添文のリンクはこちら
ベバシズマブBS「アムジェン」と抗凝固剤は併用注意に該当します[1]。
ヘパリン、ワルファリン等の抗凝固剤との併用は、出血リスクを増強させ、出血があらわれるおそれがありますので注意してください[1]。
<引用>
1. ベバシズマブBS点滴静注「アムジェン」 インタビューフォーム
※最新の情報は電子添文をご確認ください。電子添文のリンクはこちら
●血栓塞栓症の既往のある患者さんに投与する場合の注意[1]
心筋梗塞、脳梗塞、深部静脈血栓症、肺塞栓症などがあらわれるおそれがあります。
〈解説〉[1]
先行バイオ医薬品(アバスチン)の海外臨床試験において先行バイオ医薬品投与群の試験結果を併合し、動脈血栓塞栓症及び静脈血栓塞栓症の危険因子を考察した結果、動脈血栓塞栓症の既往を有している患者さん及び静脈血栓塞栓症の既往を有している患者さんでは、それぞれ、本剤(アバスチン)投与期間中の動脈血栓塞栓症の発現リスク及び本剤投与期間中の静脈血栓塞栓症の発現リスクが高くなると考えられました。したがって、投与開始前に、動脈血栓塞栓症及び静脈血栓塞栓症に関する既往の有無を確認するとともに、このような患者さんに本剤を投与する場合には、特に注意し、細かい観察を十分に行うなどの慎重な対応を行う必要があります。
<引用>
1. ベバシズマブBS「アムジェン」 インタビューフォーム
※最新の情報は電子添文をご確認ください。電子添文のリンクはこちら
●糖尿病患者さんに投与する場合の注意[1]
動脈血栓塞栓症の発現リスクが高くなるおそれがあります。
〈解説〉[1]
糖尿病患者さんで本剤投与により動脈血栓塞栓症の発現リスクが高まるとの報告があることから設定しました。
<引用>
1. ベバシズマブBS「アムジェン」 インタビューフォーム
※最新の情報は電子添文をご確認ください。電子添文のリンクはこちら
●高血圧症の患者さんに投与する場合の注意[1]
高血圧が悪化するおそれがあります。蛋白尿の発現率が上昇することがあります。
〈解説〉[1]
本剤の投与により高血圧が発現することが知られており、先行バイオ医薬品(アバスチン)において高血圧性脳症及び高血圧性クリーゼが発現し、死亡に至った例が報告されています。また、臨床試験において「高血圧がコントロールされていない患者さん」は試験対象から除外されたため、これらの患者さんに対する本剤の安全性情報は確認されていません。したがって、投与開始前に、高血圧症の有無及び既往歴について確認し、患者さんの状態に応じて、投与適否の検討及び判断を行う必要があります。また、「高血圧症の患者さん」に対して本剤を投与する場合には、降圧剤等の内科的治療などにより適切に血圧をコントロールした上で投与を開始し、本剤の投与期間中は特に細かい観察を十分に行うなど慎重な対応を行う必要があります。なお、本剤の投与期間中は、高血圧症の有無にかかわらず、すべての患者さんにおいて定期的な血圧測定を行ってください。
<引用>
1. ベバシズマブBS「アムジェン」 インタビューフォーム
※最新の情報は電子添文をご確認ください。電子添文のリンクはこちら
本剤では、うっ血性心不全または冠動脈疾患などの重篤な心疾患のある患者さんへの投与について検証したデータはありません。
ただし、うっ血性心不全または冠動脈疾患などの重篤な心疾患のある患者さんでは、本剤の投与により、うっ血性心不全が悪化またはあらわれるおそれがありますので注意が必要です[1]。
〈参考〉[2]
先行バイオ医薬品(アバスチン)の転移性乳癌を対象とした海外臨床試験において、対照群と比較してうっ血性心不全の発現率が高かったとの報告があります。アントラサイクリン系薬剤による前治療の影響などで投与前にうっ血性心不全または冠動脈疾患などの重篤な心疾患のある患者さんについては、症状の増悪のおそれがあります。
<引用>
1. ベバシズマブBS「アムジェン」 電子添文
2. ベバシズマブBS「アムジェン」 インタビューフォーム
※最新の情報は電子添文をご確認ください。電子添文のリンクはこちら
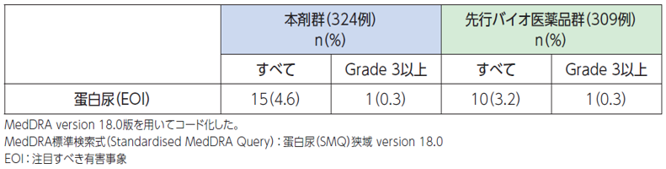
腎糸球体血管内皮細胞の形成や修復に関与するVEGF(血管内皮増殖因子)を本剤が阻害することにより、糸球体通過能が増加した結果、尿中に蛋白が移行する可能性が考えられます[1]。
●具体的な事象名:蛋白尿、ネフローゼ症候群[1]
●副作用発現率[1]
非小細胞肺癌患者さんを対象とした本剤の海外第Ⅲ相臨床試験における蛋白尿、ネフローゼ症候群に関連する副作用発現率は次のとおりでした。
●蛋白尿、ネフローゼ症候群に関連する副作用発現率(海外データ)【図表】[1]
●副作用が発現した場合の対処法[1]
高度の蛋白尿などの異常が認められた場合には、投与を中止し、適切な処置を行ってください。蛋白尿の発現率は、本剤の用量に相関して上昇する傾向が示唆されています。
●副作用の予防法[1]
蛋白尿があらわれることがあるので、投与期間中は蛋白尿を定期的に検査してください。
<引用>
1. ベバシズマブBS「アムジェン」 適正にご使用いただくために
※最新の情報は電子添文をご確認ください。電子添文のリンクはこちら
本剤の投与時にはバイアルから必要量の薬液を注射筒で抜き取り、日本薬局方生理食塩液に添加して約100mLとしてください[1]。
〈バイアルからの薬液の必要抜き取り量計算式〉
なお、100mg製剤と400mg製剤は濃度が同じであるため、上記の計算式は共通です。
日本薬局方生理食塩液以外は使用しないでください[1]。
用時調製し、調製後は速やかに使用してください。
また、残液は廃棄してください。
初回投与時は90分かけて点滴静注してください。初回投与の忍容性が良好であれば、2回目の投与は60分間で行うことができます[1]。
2回目の投与においても忍容性が良好であれば、それ以降の投与は30分間投与とすることができます。
<引用>
1. ベバシズマブBS「アムジェン」 電子添文
※最新の情報は電子添文をご確認ください。電子添文のリンクはこちら
本剤では、大きな手術の術創が治癒していない患者さんへの投与について検証したデータはありません。
ただし、創傷治癒遅延による合併症があらわれるおそれがあります。臨床試験において大きな手術後28日間経過していない患者さんに本剤を投与した経験はありません[1]。
〈参考〉[2]
先行バイオ医薬品(アバスチン)の非臨床試験において、創傷治癒過程への影響が報告されています。創傷治癒に関連する因子はVEGFだけではないものの、本剤の創傷治癒に及ぼす影響が否定できないと考えられたことから、臨床試験における安全対策として、大きな手術※後28日間経過していない患者さんが試験対象から除外されました。また、本剤(アバスチン)の海外臨床試験において、試験中あるいは試験終了後に、創傷治癒遅延に伴う合併症(創し開、術後出血等)が、化学療法単独群と比較し、本剤併用群で高頻度に認められました。本剤の投与終了後であっても、手術を行う場合には、安全性を考慮して、術創の治癒に及ぼす本剤の影響がなくなるまでは、手術までの間に十分な期間をおくことが望ましいと考えられます。しかしながら、創傷治癒遅延を回避できる適切な間隔は明らかになっていないため、本剤の投与終了後に手術を行う場合には、本剤の半減期を考慮して最終投与日を設定するなど本剤の投与計画を検討する必要があります。
※大きな手術:開腹、開胸、全身麻酔を伴う手術、臓器切除を伴う手術、腹腔鏡手術等
<引用>
1. ベバシズマブBS「アムジェン」 電子添文
2. ベバシズマブBS「アムジェン」 インタビューフォーム
※最新の情報は電子添文をご確認ください。電子添文のリンクはこちら
ベバシズマブBS「アムジェン」では、消化管など腹腔内の炎症を合併している患者さんへの投与について検証したデータはありません。
ただし、消化管穿孔があらわれるおそれがありますので注意が必要です[1]。
〈参考〉 [2]
先行バイオ医薬品(アバスチン)の国内外臨床試験及び海外市販後において、消化管穿孔が認められた多くの患者さんに、腫瘍壊死、憩室炎、がん化学療法に関連する大腸炎等の腹腔内の炎症や、胃潰瘍等の合併がありました。「消化管など腹腔内の炎症を合併している患者さん」においては、投与の適否を慎重に判断する必要があります。また、投与期間中、このような患者さんにおいては特に注意し、腹痛などの予兆を見逃さずに、消化管穿孔への迅速かつ適切な対応を行う必要があります。
<引用>
1. ベバシズマブBS「アムジェン」 電子添文
2. ベバシズマブBS「アムジェン」 インタビューフォーム
※最新の情報は電子添文をご確認ください。電子添文のリンクはこちら
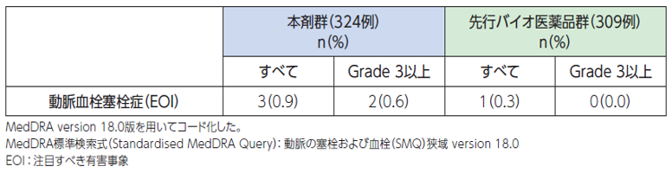
内皮細胞の機能低下や損傷ならびに血小板機能障害が関与し、血栓形成を引き起こすことがあります[1]。
●具体的な事象名:脳卒中、一過性脳虚血発作、心筋梗塞、狭心症、脳虚血、脳梗塞 等[1]
●副作用発現率[1]
非小細胞肺癌患者さんを対象とした本剤の海外第Ⅲ相臨床試験における動脈血栓塞栓症に関連する副作用発現率は次のとおりでした。
〇動脈血栓塞栓症に関連する副作用発現率(海外データ)【図表】[1]
●副作用が発現した場合の対処法[1]
脳卒中、一過性脳虚血発作、心筋梗塞、狭心症、脳虚血、脳梗塞があらわれ、死亡に至る例が報告されているため、本剤の投与を中止し、適切な処置を行ってください。このような動脈血栓塞栓症があらわれた患者さんでは、重度の動脈血栓塞栓症が再発するおそれがあるので、本剤を再投与しないでください。
<引用>
1. ベバシズマブBS「アムジェン」 適正にご使用いただくために
※最新の情報は電子添文をご確認ください。電子添文のリンクはこちら
VEGF(血管内皮増殖因子)のキャリアである血小板が静脈血栓塞栓症の増加に関与する可能性がある一方、内皮細胞の損傷も発生機序として考えられています。本剤が血栓形成を引き起こす機序は明確ではありませんが、血栓形成を引き起こすことがあります[1]。
●具体的な事象名:深部静脈血栓症、肺塞栓症 等[1]
●副作用発現率[1]
非小細胞肺癌患者さんを対象とした本剤の海外第Ⅲ相臨床試験における静脈血栓塞栓症に関連する副作用発現率は次のとおりでした。
〇静血栓塞栓症に関連する副作用発現率(海外データ)【図表】[1]
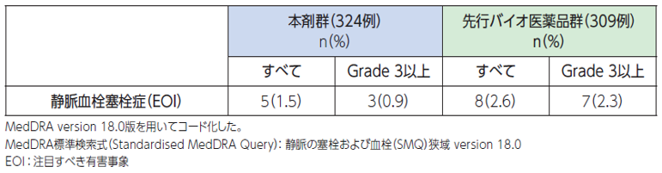
●副作用が発現した場合の対処法[1]
静脈血栓塞栓症があらわれた場合、観察を十分に行い、異常が認められた場合には、本剤の投与を中止し、適切な処置を行ってください。
<引用>
1. ベバシズマブBS「アムジェン」 適正にご使用いただくために
※最新の情報は電子添文をご確認ください。電子添文のリンクはこちら
本剤により、創傷治癒遅延が起こることが非臨床のデータで示唆されており、治療でも同様です[1]。さらに、本剤が引き起こす皮下動脈血栓症、組織の虚血が壊死性筋膜炎を引き起こす可能性が病態生理学的に考えられます。
<引用>
1. ベバシズマブBS「アムジェン」 適正にご使用いただくために
※最新の情報は電子添文をご確認ください。電子添文のリンクはこちら
ベバシズマブBS「アムジェン」の肺癌における効能又は効果、用法及び用量は次のとおりです。
●効能又は効果[1]
扁平上皮癌を除く切除不能な進行・再発の非小細胞肺癌
●用法及び用量[1]
他の抗悪性腫瘍剤との併用において、通常、成人にはベバシズマブ(遺伝子組換え)[ベバシズマブ後続2]として1回15mg/kg(体重)を点滴静脈内注射する。投与間隔は3週間以上とする。
〇扁平上皮癌を除く切除不能な進行・再発の非小細胞肺癌
6. 本剤は白金系抗悪性腫瘍剤を含む他の抗悪性腫瘍剤との併用により開始すること。
<引用>
1. ベバシズマブBS「アムジェン」 電子添文
※最新の情報は電子添文をご確認ください。電子添文のリンクはこちら
ベバシズマブBS「アムジェン」の乳癌における効能又は効果、用法及び用量は次のとおりです。
●効能又は効果[1]
手術不能又は再発乳癌
●用法及び用量[1]
パクリタキセルとの併用において、通常、成人にはベバシズマブ(遺伝子組換え)[ベバシズマブ後続2]として1回10mg/kg(体重)を点滴静脈内注射する。投与間隔は2週間以上とする。
〇手術不能又は再発乳癌
4. 本剤はパクリタキセルとの併用により開始すること。
<引用>
1. ベバシズマブBS「アムジェン」 電子添文
※最新の情報は電子添文をご確認ください。電子添文のリンクはこちら
ベバシズマブBS「アムジェン」の卵巣癌における効能又は効果、用法及び用量は次のとおりです。
●効能又は効果[1]
卵巣癌
●用法及び用量[1]
〇卵巣癌
他の抗悪性腫瘍剤との併用において、通常、成人にはベバシズマブ(遺伝子組換え)として1回10mg/kg(体重)を2週間間隔又は1回15mg/kg(体重)を3週間間隔で点滴静脈内注射する。なお、患者の状態により投与間隔は適宜延長すること。
○卵巣癌
4. 本剤と併用する他の抗悪性腫瘍剤は、「17.臨床成績」の項の内容を熟知し、国内外の最新のガイドライン等を参考にした上で選択してください。
5. 本剤とカルボプラチン及びパクリタキセルを併用する場合は、併用投与終了後も本剤単独投与を継続してください(本剤を継続投与しない場合の有効性は確認されていません)。
<引用>
1. ベバシズマブBS「アムジェン」 電子添文
※最新の情報は電子添文をご確認ください。電子添文のリンクはこちら
ベバシズマブBS「アムジェン」の悪性神経膠腫における効能又は効果、用法及び用量は次のとおりです。
●効能又は効果[1]
悪性神経膠腫
●用法及び用量[1]
〇悪性神経膠腫
通常、成人にはベバシズマブ(遺伝子組換え)[ベバシズマブ後続2]として1回10mg/kg(体重)を2週間間隔又は1回15mg/kg(体重)を3週間間隔で点滴静脈内注射する。なお、患者の状態により投与間隔は適宜延長すること。
●効能又は効果に関連する注意[1]
「17.臨床成績」の項の内容を熟知し、本剤の有効性及び安全性を十分に理解した上で、治療歴、病理組織型等を踏まえて適応患者の選択を行うこと。
●用法及び用量に関連する注意[1]
○効能共通
<引用>
1. ベバシズマブBS点滴静注「アムジェン」 電子添文
※最新の情報は電子添文をご確認ください。電子添文のリンクはこちら
製品の詳細および最新の情報は添付文書をご参照ください。
弊社製品の使用後に有害事象が認められた場合、弊社製品に不具合が認められた場合は、弊社担当者までご報告をお願いいたします。引き続き、弊社製品の詳細調査などへのご協力お願いいたします。

FAQでお探しの情報が見つからない場合、AskAm(アスクアン・AIチャットボット)もご利用ください。
弊社製品情報に関するご質問への回答や、関連する選択肢が表示され、お求めの情報に速やかに到達することができます。

医療関係者を対象とした、製品に関するお問い合わせ窓口です。
アムジェン株式会社では、お問い合わせ内容を正確に聞き取るため、また回答の質の維持・向上のため、当センターにおける受発信の通話を録音させていただいております。